【スマート・ソリューション】
製薬工場スマート化ソリューション ~“Smart GMP Factory”構想と現場適用
1.はじめに
製造業においてIndustry4.0を実践するための工場をスマートファクトリと位置付ける概念が一般化してきた。ータやデジタル技術を活用して生産プロセスを最適化し,生産性と品質の向上を図ると共にコスト削減を実現しようとする取り組みが進んでいる。スマートファクトリを実現するために活用するデジタル技術は,IoT,クラウドコンピューティング,AI,データ解析,サイバーセキュリティ,AR,エッジコンピューティング,高速通信,デジタルツインなど多岐に渡る。
一般的な製造業におけるスマートファクトリの概念に対して,製薬工場は医薬品製造における規制要件への適合など,一部,異なる対応が求められる。このような背景から製薬企業向けのデジタル技術の活用のためのコンセプトとして,2017年頃から病院や製薬業界向けのデジタル技術ソリューションを開発するドイツ企業よりIndustry4.0を応用する形でPharma4.0が提唱された。
Pharma4.0はドイツの製薬業界中心に同業界におけるデジタル化の取り組みとして広がり,近年では世界的な注目を集めている。製薬工場スマート化の考え方とニーズは,製薬工場のPharma4.0対応と言い換えることができることから,本稿では当社におけるPharma4.0の捉え方と関連するソリューション技術および現場適用の留意点などについて紹介する。
2.製薬工場スマート化の期待とニーズ
Pharma4.0における期待効果を以下に例示する。
1)サプライチェーンの可視化:デジタル技術を用いてサプライチェーン全体を可視化し,在庫の最適化,リードタイムの短縮,製品のトレーサビリティの向上を目指す。また,外部パートナとのデータ共有により,需要予測や予防保全なども可能となる。
2)スマートマニュファクチャリング:先端技術の統合により,医薬品の生産プロセスをリアルタイムで監視・管理し,品質,安全性,効率性を向上させることができる。たとえば,工場内の機器や設備をネットワークで繋ぎ,センサやカメラから得られるデータを解析して製品の追跡や管理を自動化することで人為的ミスの低減が可能になる。またこれらを予防保全に活用することでダウンタイム削減や設備の延命も可能となる。
3)人工知能(AI)と機械学習(ML):AIやMLを活用して,大量のデータを解析し,製造管理および品質管理における基準値の最適化等を効率的に把握することが可能となる。
4)規制遵守:規制となるGMP(Good Manufacturing Practiceの略であり,日本語では「医薬品の製造管理および品質管理の基準」と表現される医薬品を製造するための要件)やJ-SOX(内部統制報告制度)などに対して,デジタル化による自動化やアクセス制限などIT統制の強化により逸脱リスクの低減が可能となる。
また,ニーズについては以下の観点からさらなる増加が見込まれる。
1)薬品製造に関する品質および安全性の確保における取り組みは,主成分となる原薬はもとより,レシピの構成要素であるすべての原材料に波及している。
2)化学メーカ等の医薬品の原薬製造等への進出と品質担保の高度化。
3)医薬以外の健康食品や食品に対する安心や安全を求める声の高まり。
3.ソリューション技術
当社横河電機(以下,当社)では,本稿のタイトルとした「Smart GMP Factory」というポートフォリオで各領域のソリューションを展開している。各領域における具体的なソリューション名は図1を参照いただくものとして,詳細説明は割愛する。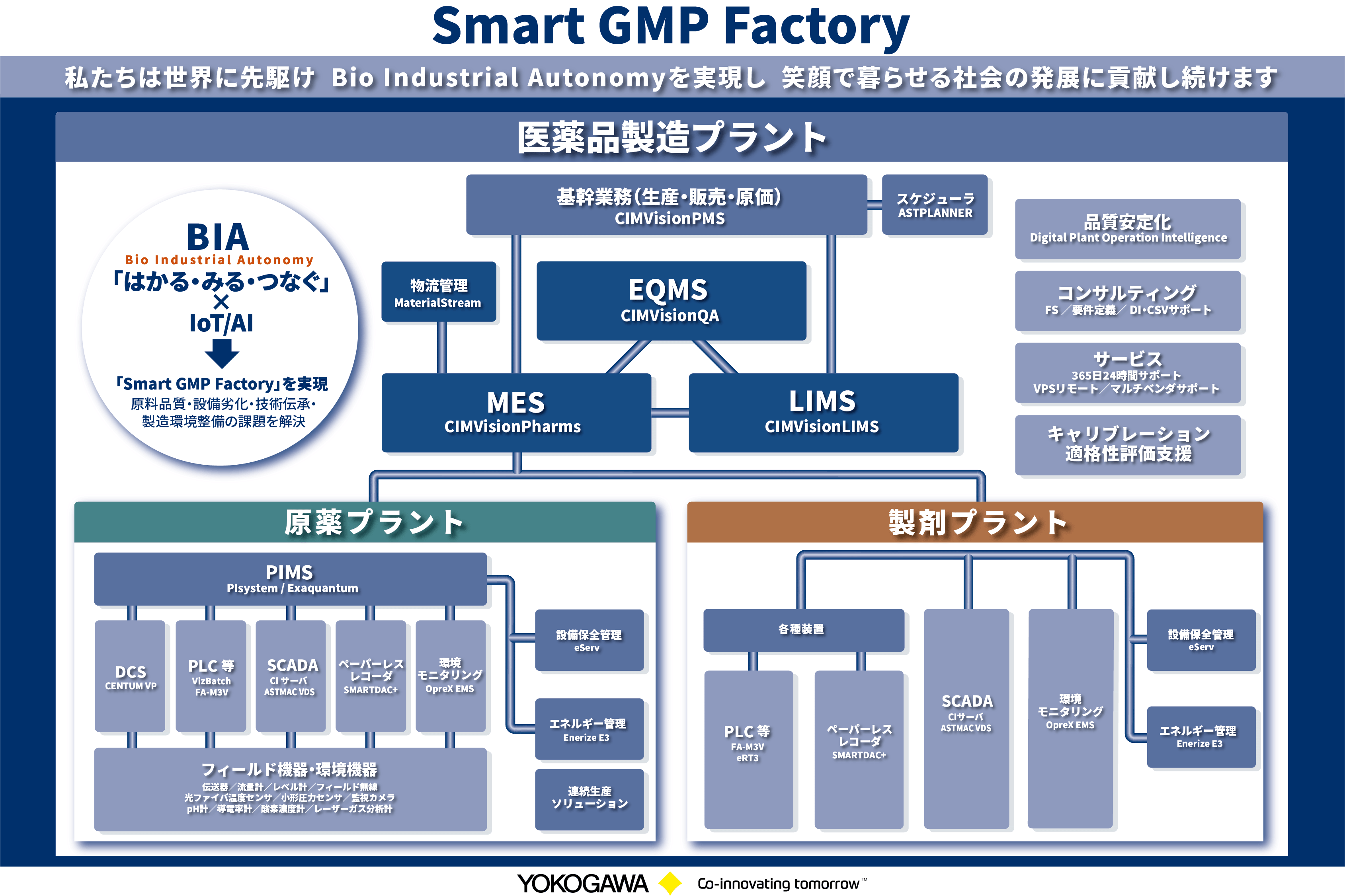
GMPを遵守するための業務領域は,製造管理および品質管理の領域と,この業務領域を包括して継続的な改善に取り組む品質マネジメントシステムの領域に大別されることから,これらすべての業務領域を包括的にカバーするMES,LIMSおよびEQMSのトリニティソリューションをSmart GMP Factoryの中核としている。さらに,生産設備,工程の各種制御機装置などの末端から収集した様々なデータを扱う,PIMS(Plant Information Management System),PLC,DCS,SCADAなどの現場と直結するソリューション群を含めている。当社ではこのSmart GMP Factoryにより医薬品製造の高度化をオールレンジで支援し,製薬工場スマート化の実現を提案している。
製薬工場スマート化を継続的に支援するためには,進化するデジタル技術をソリューションに応用するための技術力向上はもとより,規制要件を理解した上で効率的な業務最適化を成し得るための総合的な技術力が最も重要であると捉えている。当社ではSmart GMP Factoryに関わる全てのメンバがGMP,CSVのDI(ALCOA++含む),ICH動向,各国から発出されるガイドライン動向等の関連するすべての要件などについて,社内で開催される定期的な学習の機会を活用して知識向上に努めると共に,ソリューション開発実務や,国内外の数多くの製薬工場への導入案件実務を通じた実践的なアプローチを通じて,SMEとしての専門性を高めている。
4.現場適用法と留意点
本項では,3つの視点から製薬工場スマート化を現場に適用する際の留意点を考察する。
4.1 目的と手段の明確化
第1のポイントは,目的の明確化についてである。製薬工場における本質的な目的はGAMP5に示された「患者の安全」「製品の品質(維持と向上)」「データインテグリティ(の確保)」の3つと,「3つの目的を前提としたデジタル化による抜本的な効率化の追求」の4点が基本であると捉えている。
つまり,製薬工場スマート化はこれらを実現するための手段であり,製薬工場スマート化を求める様々な顧客の目的や課題に寄り添った最適なソリューションの提供が我々のミッションの第一義と考えている。
4.2 製薬工場スマート化に向けたグランドデザイン
第2のポイントは,将来あるべき製薬工場スマート化の完成形を描いた上で,デジタライゼーションの優先順位等を明確にしてロードマップに落とし込むといった総合的なグランドデザインの重要性の認識である。当社では製造業におけるDX支援をコンサルティングサービスとして提供しており,製薬工場スマート化の初期の段階から支援させていただいている。
以降では,これら初期の企画構想をユーザ側で検討する際の留意点を示した上で,当社がコンサルティングする際に活用するフレームワークの一部について紹介する。
製薬工場スマート化はDX対応の一部とも言えるため,DX対応の観点から補足すると,経産省から発出されているDXスキル標準に定義されたビジネスアーキテクトとデザイナが前述したグランドデザインを描く上でのキーマンとなる。しかしながら製薬工場では,このようなグランドデザインを描くような活動を専門的に担う組織がない場合が多く,IT部門やITに詳しい事業部門の担当者などが本来業務と兼任する期間限定のプロジェクト等で対応する場合が多い。つまり,製薬工場スマート化に際して最重要であるプランニング段階で,本質的なキーマンが不在の状態で検討されている可能性に留意する必要がある。
このような場合の対応は,製薬工場に全社的な業務を把握して可視化し標準化した上でデジタルの視点を含めて継続的に改善して生産性向上を担う役割を持つ組織を立ち上げるか,外部のコンサルタントを活用するかの何れかとなる。
続いて,当社がコンサルティングする際に活用するフレームワークの一部を紹介する。本項で紹介するフレークワークは「S.I.R.I.」(Smart Industry Readiness Index)と呼ばれるもので「スマートインダストリ準備指標」と訳す。
S.I.R.I.を活用することで,対象の製薬工場におけるデジタライゼーションの現況を客観的な尺度で把握できる。また,同フレームワークに基づく各機能領域への影響度を評価することで,優先する業務分野を特定できる。これらの結果を踏まえて対象となる機能領域ごとにヒアリングを通じて課題を特定することで,論理性を踏まえた説得力のある製薬工場スマート化のロードマップの策定が可能となる。
なお,S.I.R.I.はシンガポール政府が開発したもので,世界経済フォーラムも有効性を認めたグローバルで評価されているフレームワークである。
4.3 CSV(コンピュータ化システムバリデーション)に関する留意点
第3の視点は,CSVについて,従来の査察対応のための文書作成といった観点から,患者の安全性にフォーカスした実効的かつ効率的な実施および文書整備の考慮についてである。これは,2022年9月13日にFDAより発出された「Computer Software Assurance for Production and Quality System Software」(以下 CSAガイダンス)に由来するものである。CSAガイダンスは医療機器のコンピュータソフトウェア保証に焦点を当てたものであるが,FDAが既存のCSVに対して前述した課題感を持っていることと,CSAについてはGAMP5と整合していることなどから,CSVはCSAにパラダイムシフトしていくと目されている。
誌面の都合上,詳細は割愛するが,従来のカテゴリ分類でCSVの対応レベルを決めていた状況に対し,患者リスクを掛け合わせて,たとえばカテゴリ分類が3以上であっても,患者リスクがゼロと判断できるのであれば,バリデーションとして実施する品質保証活動は「ベンダオーディットと基本的な品質保証に拠る」とするなど,コンプライアンスコストの低減が可能となる。
なお,CSVの取り組みは基本的にGMP組織が主導することになるため,主にはユーザ側の留意点と捉える。
5.終わりに
当社のソリューションの一部と取り組みの留意点等について広く紹介させていただいた。しかしながら,誌面の都合上,詳細の多くを割愛させていただいている。もし,本記事において興味を引く内容があれば当社ホームページより情報を入手いただきたい。
当社を製薬工場スマート化におけるDX支援とソリューション提供の両面で伴走し共創するパートナとしてご指名いただけたら幸いである。我々は自分事の視座をもって顧客ニーズに寄り添い貢献し続けることをお約束する。